1998 LS 8.1 Metallbindung standard: Unterschied zwischen den Versionen
Neh (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
Neh (Diskussion | Beiträge) |
||
| (47 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
[[1998_LS_8.1_Metallbindung| Link zur übergeordneten Seite]] | [[1998_LS_8.1_Metallbindung| Link zur übergeordneten Seite]] | ||
== | == Metalle, Halbmetalle und Nichtmetalle == | ||
<!--Bild PSE Metalle, Nichtmetalle, Halbmetalle--> | |||
80 % aller Elemente im [https://www.abiweb.de/assets/courses/media/pse-metalle-print.jpg Periodensystem der Elemente (PSE)] sind Metalle. Metalle sind Elemente mit metallischen Eigenschaften (hohe elektrische und thermische Leitfähigkeit, Glanz, Härte, Duktilität und die Fähigkeit zur Bildung metallischer Bindungen). '''Metalle''' stehen links von den Halbmetallen und Nichtmetallen im PSE (Ausnahme H Wasserstoff). | |||
80 % aller Elemente im Periodensystem der Elemente (PSE) sind Metalle. Metalle sind Elemente mit metallischen Eigenschaften (hohe elektrische und thermische Leitfähigkeit, Glanz, Härte, Duktilität und die Fähigkeit zur Bildung metallischer Bindungen). '''Metalle''' stehen links im PSE. | |||
Rechts im PSE stehen die '''Nichtmetalle'''. Die Nichtmetalle haben nicht die metallischen Eigenschaften (einzelne metallische Eigenschaften können vorkommen). | Rechts im PSE stehen die '''Nichtmetalle'''. Die Nichtmetalle haben nicht die metallischen Eigenschaften (einzelne metallische Eigenschaften können vorkommen). | ||
Zwischen den Metallen und Nichtmetallen gibt es '''Halbmetalle'''. Die Halbmetalle haben | Zwischen den Metallen und Nichtmetallen gibt es '''Halbmetalle'''. Die Halbmetalle haben Eigenschaften zwischen den Metallen und Nichtmetallen. Sie sind z.B. nicht so gute elektrische Leiter wie Metalle, aber auch nicht so schlechte elektrische Leiter wie Nichtmetalle. | ||
== Verbindung von Atomen == | == Verbindung von Atomen == | ||
<!-- Bild/Animation Atommodell mit Abgabe der Valenzelektronen --> | |||
<gallery> | |||
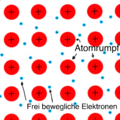
Elektronengasmodell.png|Metallbindung | |||
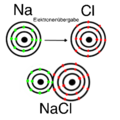
Ionenbindung_NaCl.png|Ionenbindung | |||
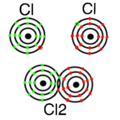
Atombindung_Cl2.png|Atombindung/Kovalente Bindung/Elektronenpaarbindung | |||
</gallery> | |||
Alle Atome wollen eine möglichst volle äußerste Schale besitzen. Metalle besitzen wenige Elektronen auf ihrer äußersten Schale. Die Abgabe der Elektronen auf der äußersten Schale ist leichter als das Auffüllen. Daher geben Metalle Valenzelektronen ab (Valenzelektronen sind Elektronen auf der äußersten Schale). | |||
Der Zusammenschluss zwischen Metallen und Nichtmetallen führt zu drei möglichen Kombinationen von Bindungen: | Der Zusammenschluss zwischen Metallen und Nichtmetallen führt zu drei möglichen Kombinationen von Bindungen: | ||
* Verbindung von Metallatom mit Nichtmetallatom - '''Ionenbindung''': Da die Elektronen vom Metall zum Nichtmetall übertragen werden, gibt es keine freien Elektronen. Ein bekanntes Beispiel ist Korund (Al<small><sub>2</sub></small>O<small><sub>3</sub></small>; Aluminium als Metall und Sauerstoff als Nichtmetall) oder Kochsalz (NaCl; Natrium als Metall mit Chlor als Nichtmetall). | |||
* Verbindung von Nichtmetallatom mit Nichtmetallatom - '''Atombindung''' (auch kovalente oder Elektronenpaar Bindung genannt): Bei dieser Bindung teilen sich zwei Nichtmetallatome die Elektronen, wodurch kaum freie Elektronen vorhanden sind. Diamant (C) ist ein Beispiel für diese Art der Bindung. Bekannte Beispiele sind: Wasser (H<sub>2</sub>O; Wasserstoff und Sauerstoff), Methan (CH<sub>4;</sub> Kohlenstoff und Wasserstoff), aber auch Kunststoffe. | |||
* Metallatom mit Metallatom - '''Metallbindung''': Wenn sich zwei Metallatome verbinden, bilden sie eine Metallbindung, wobei die Valenzelektronen frei zwischen den Atomen beweglich sind. Dies verleiht Metallen ihre charakteristischen Eigenschaften. Alle Metalle sind Beispiele für diese Art der Bindung. | |||
Diese Erkenntnisse bilden das Grundgerüst für das Verständnis der chemischen Bindungen und der Eigenschaften von Materialien und sind somit zentral für die Chemie und die Materialwissenschaft. | Diese Erkenntnisse bilden das Grundgerüst für das Verständnis der chemischen Bindungen und der Eigenschaften von Materialien und sind somit zentral für die Chemie und die Materialwissenschaft. | ||
| Zeile 27: | Zeile 33: | ||
===Kristalliner Aufbau=== | ===Kristalliner Aufbau=== | ||
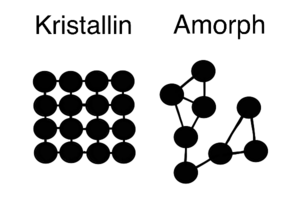
[[Datei:Kristallin Amorph.png|alternativtext=Kristallin_Amorph|rechts|mini|300x300px|Kristallin und Amorph Aufbau in 2D]] Metalle bilden als Metallbindung (Metallatom mit Metallatom) häufig regelmäßige, periodisch wiederkehrende Atomanordnungen. Stoffe mit regelmäßig angeordneten Atomen nennt man '''kristallin'''. Metallbindungen sind demnach kristallin. Das Gegenteil von kristallin ist amorph. '''Amorphe''' Stoffe haben nicht regelmäßig angeordnete Atome. | |||
=== | |||
Abstand der | |||
===Regelmäßige Anordnung durch Anziehung und Abstoßung=== | |||
<gallery> | |||
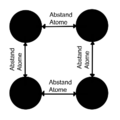
Anziehung_Abstoßung_Metallatome_2D.png|Anziehung und Abstoßung der Metallatome in 2D | |||
Abstand_Metallatome_2D.png|Abstand Metallatome bei Anziehung=Abstoßung in 2D | |||
</gallery> | |||
Atome in Metallbindungen ordnen sich regelmäßig an. Da sich in der Chemie gegensätze anziehen und gleiches abstößt kann man sich die Metallionen (+) umgeben von der Elektronenhülle (-) im Gitter mit den Valenzelektronen (-) vorstellen. | |||
Die positiven Metallionen werden von den den negativen Valenzelektronen angezogen. Die Metallionen (+) nähern sich anderen Metallionen (+), dabei wird die Abstoßung umso stärker, umso näher sie sich kommen. | |||
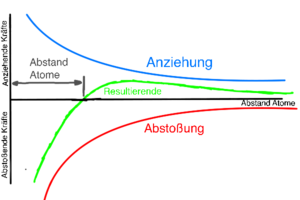
Es wirken also anziehende Kräfte und abstoßende Kräfte, gemeinsam bilden diese beiden Kräfte die resultierende Kraft. | |||
Die Anziehung und Abstoßung gleichen sich an einem bestimmten Abstand aus. Die Anziehung und Abstoßung sind an diesem Abstand also gleich groß. Dies ist der Abstand der Atome. | |||
== Übung == | == Übung == | ||
H5P Übung | H5P Übung | ||
[[Datei:ICON LS Moodle.png|left|40x40px|link=https://ad-bk.lms.schulon.org]] '''Schüler*in des ADBK-Düsseldorf? Dann finden Sie die interaktive Übung in Moodle.''' | |||
[[Datei:Icon_Sprinter.png|left|40x40px]] '''Nachfolgend die Sprinterinhalte''' | |||
== Sprinterinhalte == | == Sprinterinhalte == | ||
===Halbmetalle=== | |||
Halbmetalle haben eine schwache elektrische Leitfähigkeit bei Raumtemperatur. Mit steigender Temperatur nimmt ihre Leitfähigkeit zu. Deswegen werden sie häufig auch zu den Halbleitern gezählt. | |||
Halbleiter sind spezielle Materialien, die man so verändern kann, dass sie manchmal Strom leiten und manchmal nicht. Diese Fähigkeit kommt durch etwas, das wir "Dotierung" nennen, zustande. Das bedeutet, wir fügen dem Halbleiter winzige Mengen eines anderen Materials hinzu, wodurch entweder zusätzliche Elektronen (negativ geladen) oder zusätzliche Lücken (wo Elektronen fehlen, positiv geladen) entstehen. | |||
===Abstand der Atome bei Metallbindungen=== | |||
[[Datei:Anziehung Abstoßung Metallbindung.png|300px|links|mini|Anziehung und Abstoßung in Metallgittern als Graph]] | |||
Aktuelle Version vom 29. Oktober 2023, 17:31 Uhr
Metalle, Halbmetalle und Nichtmetalle
80 % aller Elemente im Periodensystem der Elemente (PSE) sind Metalle. Metalle sind Elemente mit metallischen Eigenschaften (hohe elektrische und thermische Leitfähigkeit, Glanz, Härte, Duktilität und die Fähigkeit zur Bildung metallischer Bindungen). Metalle stehen links von den Halbmetallen und Nichtmetallen im PSE (Ausnahme H Wasserstoff).
Rechts im PSE stehen die Nichtmetalle. Die Nichtmetalle haben nicht die metallischen Eigenschaften (einzelne metallische Eigenschaften können vorkommen).
Zwischen den Metallen und Nichtmetallen gibt es Halbmetalle. Die Halbmetalle haben Eigenschaften zwischen den Metallen und Nichtmetallen. Sie sind z.B. nicht so gute elektrische Leiter wie Metalle, aber auch nicht so schlechte elektrische Leiter wie Nichtmetalle.
Verbindung von Atomen
Alle Atome wollen eine möglichst volle äußerste Schale besitzen. Metalle besitzen wenige Elektronen auf ihrer äußersten Schale. Die Abgabe der Elektronen auf der äußersten Schale ist leichter als das Auffüllen. Daher geben Metalle Valenzelektronen ab (Valenzelektronen sind Elektronen auf der äußersten Schale).
Der Zusammenschluss zwischen Metallen und Nichtmetallen führt zu drei möglichen Kombinationen von Bindungen:
- Verbindung von Metallatom mit Nichtmetallatom - Ionenbindung: Da die Elektronen vom Metall zum Nichtmetall übertragen werden, gibt es keine freien Elektronen. Ein bekanntes Beispiel ist Korund (Al2O3; Aluminium als Metall und Sauerstoff als Nichtmetall) oder Kochsalz (NaCl; Natrium als Metall mit Chlor als Nichtmetall).
- Verbindung von Nichtmetallatom mit Nichtmetallatom - Atombindung (auch kovalente oder Elektronenpaar Bindung genannt): Bei dieser Bindung teilen sich zwei Nichtmetallatome die Elektronen, wodurch kaum freie Elektronen vorhanden sind. Diamant (C) ist ein Beispiel für diese Art der Bindung. Bekannte Beispiele sind: Wasser (H2O; Wasserstoff und Sauerstoff), Methan (CH4; Kohlenstoff und Wasserstoff), aber auch Kunststoffe.
- Metallatom mit Metallatom - Metallbindung: Wenn sich zwei Metallatome verbinden, bilden sie eine Metallbindung, wobei die Valenzelektronen frei zwischen den Atomen beweglich sind. Dies verleiht Metallen ihre charakteristischen Eigenschaften. Alle Metalle sind Beispiele für diese Art der Bindung.
Diese Erkenntnisse bilden das Grundgerüst für das Verständnis der chemischen Bindungen und der Eigenschaften von Materialien und sind somit zentral für die Chemie und die Materialwissenschaft.
Metallbindung
Kristalliner Aufbau
Metalle bilden als Metallbindung (Metallatom mit Metallatom) häufig regelmäßige, periodisch wiederkehrende Atomanordnungen. Stoffe mit regelmäßig angeordneten Atomen nennt man kristallin. Metallbindungen sind demnach kristallin. Das Gegenteil von kristallin ist amorph. Amorphe Stoffe haben nicht regelmäßig angeordnete Atome.
Regelmäßige Anordnung durch Anziehung und Abstoßung
Atome in Metallbindungen ordnen sich regelmäßig an. Da sich in der Chemie gegensätze anziehen und gleiches abstößt kann man sich die Metallionen (+) umgeben von der Elektronenhülle (-) im Gitter mit den Valenzelektronen (-) vorstellen.
Die positiven Metallionen werden von den den negativen Valenzelektronen angezogen. Die Metallionen (+) nähern sich anderen Metallionen (+), dabei wird die Abstoßung umso stärker, umso näher sie sich kommen.
Es wirken also anziehende Kräfte und abstoßende Kräfte, gemeinsam bilden diese beiden Kräfte die resultierende Kraft.
Die Anziehung und Abstoßung gleichen sich an einem bestimmten Abstand aus. Die Anziehung und Abstoßung sind an diesem Abstand also gleich groß. Dies ist der Abstand der Atome.
Übung
H5P Übung
Schüler*in des ADBK-Düsseldorf? Dann finden Sie die interaktive Übung in Moodle.
Nachfolgend die Sprinterinhalte
Sprinterinhalte
Halbmetalle
Halbmetalle haben eine schwache elektrische Leitfähigkeit bei Raumtemperatur. Mit steigender Temperatur nimmt ihre Leitfähigkeit zu. Deswegen werden sie häufig auch zu den Halbleitern gezählt.
Halbleiter sind spezielle Materialien, die man so verändern kann, dass sie manchmal Strom leiten und manchmal nicht. Diese Fähigkeit kommt durch etwas, das wir "Dotierung" nennen, zustande. Das bedeutet, wir fügen dem Halbleiter winzige Mengen eines anderen Materials hinzu, wodurch entweder zusätzliche Elektronen (negativ geladen) oder zusätzliche Lücken (wo Elektronen fehlen, positiv geladen) entstehen.