1998 LS 8.1 Metallbindung einfache sprache: Unterschied zwischen den Versionen
Neh (Diskussion | Beiträge) (Die Seite wurde neu angelegt: „ Link zur übergeordneten Seite == Metalle, Halbmetalle und Nichtmetalle == <!--Bild PSE Metalle, Nichtmetalle, Halbmetalle--> 80 % aller Elemente im Periodensystem der Elemente (PSE) sind Metalle. Metalle sind Elemente mit metallischen Eigenschaften (hohe elektrische und thermische Leitfähigkeit, Glanz, Härte, Duktilität und die Fähigkeit zur Bildung metallischer Bindungen). '''Metalle''' stehen links im PSE (Ausnahme…“) |
Neh (Diskussion | Beiträge) |
||
| Zeile 24: | Zeile 24: | ||
Wenn Atome sich miteinander verbinden, können verschiedene "Bindungen" entstehen: | Wenn Atome sich miteinander verbinden, können verschiedene "Bindungen" entstehen: | ||
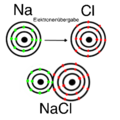
Metallatom + Nichtmetallatom = Ionenbindung: Hier gibt das Metall seine Elektronen an das Nichtmetall ab. Bei dieser Verbindung sind keine Elektronen frei. Beispiele dafür sind: | 1. Metallatom + Nichtmetallatom = Ionenbindung: Hier gibt das Metall seine Elektronen an das Nichtmetall ab. Bei dieser Verbindung sind keine Elektronen frei. Beispiele dafür sind: | ||
*Korund (Al<sub>2</sub>O<sub>3</sub>): Hier verbindet sich Aluminium (Metall) mit Sauerstoff (Nichtmetall). | *Korund (Al<sub>2</sub>O<sub>3</sub>): Hier verbindet sich Aluminium (Metall) mit Sauerstoff (Nichtmetall). | ||
*Kochsalz (NaCl): Natrium (Metall) verbindet sich mit Chlor (Nichtmetall). | *Kochsalz (NaCl): Natrium (Metall) verbindet sich mit Chlor (Nichtmetall). | ||
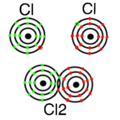
Nichtmetallatom + Nichtmetallatom = Atombindung: Bei dieser Verbindung teilen sich die beiden Nichtmetalle ihre Elektronen. Das bedeutet, sie "leihen" einander Elektronen. Beispiele dafür sind: | 2. Nichtmetallatom + Nichtmetallatom = Atombindung: Bei dieser Verbindung teilen sich die beiden Nichtmetalle ihre Elektronen. Das bedeutet, sie "leihen" einander Elektronen. Beispiele dafür sind: | ||
*Wasser (H<sub>2</sub>O): Hier teilen sich Wasserstoff und Sauerstoff ihre Elektronen. | *Wasser (H<sub>2</sub>O): Hier teilen sich Wasserstoff und Sauerstoff ihre Elektronen. | ||
*Methan (CH<sub>4</sub>): Hier teilen sich Kohlenstoff und Wasserstoff ihre Elektronen. | *Methan (CH<sub>4</sub>): Hier teilen sich Kohlenstoff und Wasserstoff ihre Elektronen. | ||
*Auch viele Kunststoffe haben diese Art von Bindung. | *Auch viele Kunststoffe haben diese Art von Bindung. | ||
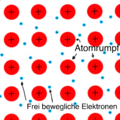
Metallatom + Metallatom = Metallbindung: Hier teilen sich Metallatome ihre Elektronen, die dann zwischen den Atomen hin und her bewegen können. Dadurch bekommen Metalle ihre besonderen Eigenschaften, wie zum Beispiel, dass sie Strom leiten können. Alle Metalle haben diese Art von Bindung. | 3. Metallatom + Metallatom = Metallbindung: Hier teilen sich Metallatome ihre Elektronen, die dann zwischen den Atomen hin und her bewegen können. Dadurch bekommen Metalle ihre besonderen Eigenschaften, wie zum Beispiel, dass sie Strom leiten können. Alle Metalle haben diese Art von Bindung. | ||
== Metallbindung == | == Metallbindung == | ||
Version vom 20. August 2023, 11:59 Uhr
Metalle, Halbmetalle und Nichtmetalle
80 % aller Elemente im Periodensystem der Elemente (PSE) sind Metalle. Metalle sind Elemente mit metallischen Eigenschaften (hohe elektrische und thermische Leitfähigkeit, Glanz, Härte, Duktilität und die Fähigkeit zur Bildung metallischer Bindungen). Metalle stehen links im PSE (Ausnahme H Wasserstoff).
Rechts im PSE stehen die Nichtmetalle. Die Nichtmetalle haben nicht die metallischen Eigenschaften (einzelne metallische Eigenschaften können vorkommen).
Zwischen den Metallen und Nichtmetallen gibt es Halbmetalle. Die Halbmetalle haben Eigenschaten zwischen den Metallen und Nichtmetallen. Sie sind z.B. nicht so gute elektrische Leiter wie Metalle aber auch nicht so schlechte elektrische Leiter wie Nichtmetalle.
Verbindung von Atomen
Atome, also die kleinsten Bausteine von allem, haben so etwas wie kleine "Schalen", in denen Elektronen (kleine Teilchen) sind. Am glücklichsten sind Atome, wenn sie in ihrer letzten Schale genau 8 Elektronen haben.
Metalle: Sie haben nur wenige Elektronen in ihrer äußersten Schale. Es ist einfacher für sie, diese wenigen Elektronen abzugeben als viele dazuzunehmen. Daher geben Metalle ihre Elektronen oft ab. Die Elektronen in der äußersten Schale nennen wir Valenzelektronen.
Wenn Atome sich miteinander verbinden, können verschiedene "Bindungen" entstehen:
1. Metallatom + Nichtmetallatom = Ionenbindung: Hier gibt das Metall seine Elektronen an das Nichtmetall ab. Bei dieser Verbindung sind keine Elektronen frei. Beispiele dafür sind:
- Korund (Al2O3): Hier verbindet sich Aluminium (Metall) mit Sauerstoff (Nichtmetall).
- Kochsalz (NaCl): Natrium (Metall) verbindet sich mit Chlor (Nichtmetall).
2. Nichtmetallatom + Nichtmetallatom = Atombindung: Bei dieser Verbindung teilen sich die beiden Nichtmetalle ihre Elektronen. Das bedeutet, sie "leihen" einander Elektronen. Beispiele dafür sind:
- Wasser (H2O): Hier teilen sich Wasserstoff und Sauerstoff ihre Elektronen.
- Methan (CH4): Hier teilen sich Kohlenstoff und Wasserstoff ihre Elektronen.
- Auch viele Kunststoffe haben diese Art von Bindung.
3. Metallatom + Metallatom = Metallbindung: Hier teilen sich Metallatome ihre Elektronen, die dann zwischen den Atomen hin und her bewegen können. Dadurch bekommen Metalle ihre besonderen Eigenschaften, wie zum Beispiel, dass sie Strom leiten können. Alle Metalle haben diese Art von Bindung.
Metallbindung
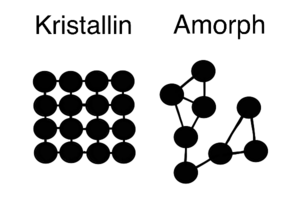
Kristalliner Aufbau
Metalle verbinden sich oft so, dass ihre Atome in einer regelmäßigen, immer wiederkehrenden Reihenfolge angeordnet sind. Wenn Atome so geordnet sind, nennt man das kristallin. Metalle sind oft in dieser kristallinen Form.
Wenn Atome nicht in einer regelmäßigen Reihenfolge angeordnet sind, ist das das Gegenteil von kristallin und wird amorph genannt. In amorphen Stoffen sind die Atome nicht gleichmäßig angeordnet.
Regelmäßige Anordnung durch Anziehung und Abstoßung
Atome in Metallbindungen ordnen sich regelmäßig an. Da sich in der Chemie gegensätze anziehen und gleiches abstößt kann man sich die Metallionen (+) umgeben von der Elektronenhülle (-) im Gitter mit den Valenzelektronen (-) vorstellen.
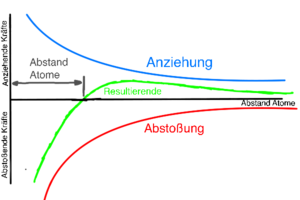
Die positiven Metallionen werden von den den negativen Valenzelektronen angezogen. Die Metallionen (+) nähern sich anderen Metallionen (+), dabei wird die Abstoßung umso stärker, umso näher sie sich kommen.
Es wirken also anziehende Kräfte und abstoßende Kräfte, gemeinsam bilden diese beiden Kräfte die resultierende Kraft.
Die Anziehung und Abstoßung gleichen sich an einem bestimmten Abstand aus. Die Anziehung und Abstoßung sind an diesem Abstand also gleich groß. Dies ist der Abstand der Atome.
Übung
H5P Übung
Sprinterinhalte
Halbmetalle
Halbmetalle haben eine schwache elektrische Leitfähigkeit bei Raumtemperatur. Mit steigender Temperatur nimmt ihre Leitfähigkeit zu. Deswegen werden sie häufig auch zu den Halbleitern gezählt.
Halbleiter sind spezielle Materialien, die man so verändern kann, dass sie manchmal Strom leiten und manchmal nicht. Diese Fähigkeit kommt durch etwas, das wir "Dotierung" nennen, zustande. Das bedeutet, wir fügen dem Halbleiter winzige Mengen eines anderen Materials hinzu, wodurch entweder zusätzliche Elektronen (negativ geladen) oder zusätzliche Lücken (wo Elektronen fehlen, positiv geladen) entstehen.