LS1.3 Radikalische Polymerisation Level 1 und 2: Unterschied zwischen den Versionen
Len (Diskussion | Beiträge) |
Akb (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| (2 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
==Die radikalische Polymerisation== | |||
Die '''radikalische Polymerisation''' ist die Grundlage der Herstellung von individuellen Abformlöffeln aus | Die '''radikalische Polymerisation''' ist die Grundlage der Herstellung von individuellen Abformlöffeln aus | ||
| Zeile 102: | Zeile 103: | ||
<div {{uebung}}> | <div {{uebung}}> | ||
'''Übung:''' Baue mit dieser Lern-App die Atome nach, aus denen das Methylmethacrylat-Molekül besteht! Mache Bildschirmfotos und '''gib''' die Bilder in | '''Übung:''' Baue mit dieser Lern-App die Atome nach, aus denen das Methylmethacrylat-Molekül besteht! Mache Bildschirmfotos und '''gib''' die Bilder in Deinem Lernmanagementsystem in der Lernlandkarte '''ab'''. | ||
<html><iframe src="https://phet.colorado.edu/sims/html/build-an-atom/latest/build-an-atom_de.html" allowfullscreen="yes" width="400" height="300"> | <html><iframe src="https://phet.colorado.edu/sims/html/build-an-atom/latest/build-an-atom_de.html" allowfullscreen="yes" width="400" height="300"> | ||
| Zeile 127: | Zeile 128: | ||
Als Folge dieses "Elektronenaustauschs" stimmt aber die Anzahl der Elektronen und Protonen in den beiden Atomen nicht mehr. Natrium hat ein Elektron zu wenig. Es ist jetzt positiv geladen. Chlor hat ein Elektron zu viel hat und ist damit negativ geladen. Solche geladenen Atome nennt man Ionen. Ionen sind also positiv oder negativ geladene Atome. Ungleiche Ladungen ziehen sich an. Das kennst Du hoffentlich von einem Magneten. Also ziehen sich diese beiden unterschiedlich geladenen Ionen an. Sie bilden ein Kochsalz-Molekül. | Als Folge dieses "Elektronenaustauschs" stimmt aber die Anzahl der Elektronen und Protonen in den beiden Atomen nicht mehr. Natrium hat ein Elektron zu wenig. Es ist jetzt positiv geladen. Chlor hat ein Elektron zu viel hat und ist damit negativ geladen. Solche geladenen Atome nennt man Ionen. Ionen sind also positiv oder negativ geladene Atome. Ungleiche Ladungen ziehen sich an. Das kennst Du hoffentlich von einem Magneten. Also ziehen sich diese beiden unterschiedlich geladenen Ionen an. Sie bilden ein Kochsalz-Molekül. | ||
Diese Bindungsart nennt man als '''Ionenbindung'''. Sie funktioniert nur zwischen Elementen mit jeweils wenig und vielen Außenelektronen | Diese Bindungsart nennt man als '''Ionenbindung'''. Sie funktioniert nur zwischen Elementen mit jeweils wenig und vielen Außenelektronen, das bedeutet zwischen Metallen und Nichtmetallen. Metalle stehen links im Periodensystem. Nichtmetalle stehen rechts im Periodensystem. | ||
Aktuelle Version vom 22. November 2024, 10:21 Uhr
Die radikalische Polymerisation
Die radikalische Polymerisation ist die Grundlage der Herstellung von individuellen Abformlöffeln aus
- lichthärtendem Kunststoff (Photopolymerisat),
- Autopolymerisat (Pulver und Flüssigkeit) und
- 3D-Druck (mit Harzen oder mit Thermoplaste).
Nur wenn Du die radikalische Polymerisation wirklich verstanden hast, kannst Du die Gesundheitsverfahren der Herstellungsverfahren wirklich beurteilen.
Du kennst das bestimmt aus dem Labor von deiner täglichen Arbeit:
Du formst den Abformlöffel aus einer fertigen Platte, stellst sie ins UV-Lichthärtegerät, wartest ein wenig ... und außer der komischen Schmierschicht auf der Oberfläche und ein wenig Schrumpfung: Fertig!
Oder: Du schickst die Datei mit dem konstruierten Löffel an den 3D-Drucker. Der Löffel entsteht Schicht für Schicht aus dem flüssigen Harz. Anschließend muss Du den Löffel mit Isopropylalkohol reinigen und noch im Lichthärtegerät nachpolymerisieren.
Oder: Du vermischt Monomer (Kunstoffflüssigkeit) mit Polymer (Kunststoffpulver), formst einen Abformlöffel mit Griff, wartest ein wenig ... und der Abformlöffel schrumpft etwas und wird von allein hart!
Was genau passiert da?
Der Grundstoff, aus dem der Kunststoff zum Anrühren (Autopolymerisat), die Kunststoffplatten zum Lichthärten (Photopolymerisat) und das Harz zum 3D-Drucken bestehen, heißt Methacrylsäuremethylester, kürzer Methylmethacrylat oder ganz kurz MMA.
Sind die einzelnen MMA-Moleküle nicht miteinander verbunden, ist eine große Ansammlung von ihnen flüssig.
In den Platten für lichthärtende Abformlöffel ist Monomer mit anderen Stoffen zu einer knetbaren Masse vermischt.
Bei den Harzen für den 3D-Druck ist das Monomer vorpolymerisiert. Es ist dann ein sogenanntes Oligomer.
Verbinden sich Monomere zu langen Ketten, ist dieses Netzwerk aus langen Ketten fest! Man nennt es dann Polymethacrylsäuremethylester oder Polymethylmethacrylat (poly heißt viele).
Wie aber schaffen es die einzelnen Moleküle so lange flüssig zu bleiben bis du sie fertig verarbeitet hast? Und wie schaffen sie es, ausgerechnet dann fest zu werden, wenn du die Löffel ins Lichthärtegerät stellst oder wenn der 3D-Drucker das Harz belichtet?
Und was genau ist an ihnen so gesundheitsgefährdend für dich?
Chemische Grundlagen der radikalischen Polymerisation (Level 1/2)
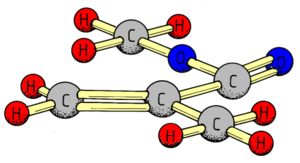
Methacrylsäuremethylester ist ein kompliziertes Molekül: Um zu lernen, wie sich die MMA-Moleküle verbinden, sind nur die beiden Kohlenstoff-Atome in der Mitte des Moleküls von Bedeutung (alles andere bezeichnen wir ab jetzt als "Rest").
Was aber ist ein "Kohlenstoff-Atom"?
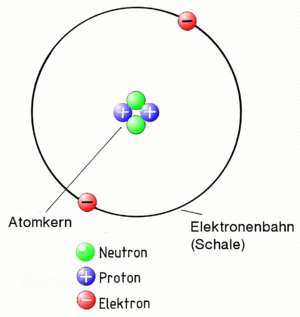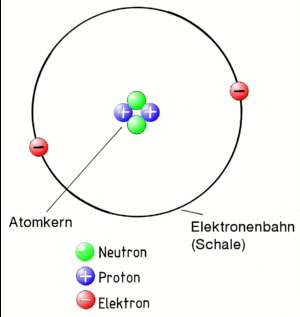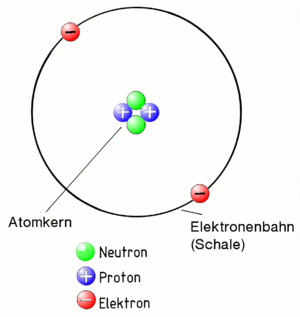
Das Bohrsche Atommodell
Zuerst der Begriff Atom:
Ein Atom besteht aus einem positiv geladenen Kern und den negativ geladenen Elektronen. Die Elektronen umkreisen den Kern auf Bahnen (auch Schalen genannt). Der Kern ist positiv geladen. Die Elektronen sind negativ. Sie werden daher vom Kern angezogen. Die Elektronen fliegen deshalb beim Umkreisen des Kerns nicht aus der Bahn. Das gesamte Gebilde "Atom" muss aber insgesamt neutral geladen sein. Daher muss ein Atom genau so viele positiv geladenen Teilchen im Kern und negative auf den Bahnen haben!
Die Protonen im Kern liegen sehr eng aneinander. Dazwischen liegen im Kern noch Neutronen. Sie sind neutral, also gar nicht geladen. Sie sorgen dafür, dass die Protonen sich nicht voneinander abstoßen.
Das alles entspricht dem Atommodell nach Niels Bohr. Er hat das vor fast 100 Jahren entwickelt. Es entspricht nicht ganz der Wirklichkeit in der Natur. Es reicht aber, um die Polymerisation zu verstehen.
Lernvideo zum Bohrschen Atommodell:
Nun zum Begriff Kohlenstoff:
Jede Atomsorte hat je nach Anzahl der Protonen im Kern einen anderen Namen. Es gibt Wasserstoff (1 Proton), Helium (2 Protonen), Lithium (3 Protonen) usw. Kohlenstoff ist das Element mit 6 Protonen und mit 6 Elektronen (gleiche Anzahl, wie oben beschrieben). Es gibt zur Zeit 116 dieser Atomsorten. Man nennt sie Elemente. Damit du nicht den Überblick verlierst, sind die Atomsorten sie im "Periodensystem der Elemente" (kurz PSE) sortiert.
Skizziere ein Kohlenstoff-Atom nach dem Bohrschen Atommodell. Gib die Skizze ein Deiner Lernlandkarte im Lernmanagementsystem ab.
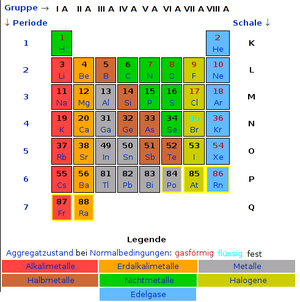
Das Periodensystem der Elemente
Das Periodensystem ist eigentlich eine Tabelle mit Zeilen und Spalten. Die Spalten heißen "Hauptgruppen". Hier findest du das Periodensystem zum Ausdrucken.
Die Zeilen heißen Perioden oder Schalen. Der Name "Schalen" wird von den Bahnen der Elektronen um den Atomkern abgeleitet. Jede Bahn oder Schale kann nur eine begrenzte Anzahl von Elektronen aufnehmen. Deshalb sind mehrere Schalen notwendig, um alle Elektronen unterzubringen. Je größer eine Schale ist, desto mehr Elektronen passen darauf.
Die Elemente sind von links nach rechts mit einer so genannten Ordnungszahl durchnummeriert. Diese Zahl entspricht der Anzahl der Protonen. Sie entspricht im neutral geladenen Zustand auch der Anzahl der Elektronen. Die Perioden oder Schalen sind mit großen Buchstaben ab "K" benannt. Sie heißen also "K", "L", "M" usw.. Die erste Periode (die K-Schale) kann max. zwei Elektronen aufnehmen. Die zweite (die L-Schale) kann max. acht Elektronen enthalten. Die dritte (M-Schale) kann max. 18 Elektronen aufnehmen. Die Formel für die max. Anzahl der Elektronen lautet 2 x n². Dabei steht n für die Nummer der Schale. Die max. Elektronen-Anzahl der zweiten Periode errechnet sich also aus 2 x 2² = 8.
Die acht wichtigsten Spalten des Periodensystems heißen Hauptgruppen. In den acht Hauptgruppen haben alle Elemente max. 8 Elektronen auf der äußersten Schale. In der ersten Hauptgruppe haben alle Elemente ein Elektron auf der äußeren Schale. In der zweiten Hauptgruppe haben alle Elemente zwei Elektronen auf der äußeren Schale usw.. Die Nummer der Hauptgruppe gibt also die Zahl der Elektronen auf der äußeren Schale an. Sie heißen Valenzelektronen und bestimmen die Eigenschaften der Elemente (Metall - Nichtmetall z.B.). Alle Elemente einer Hauptgruppe haben gleich viele Elektronen auf der äußeren Schale (Außenelektronen). Deshalb haben diese Elemente jeweils ähnliche chemische Eigenschaften.
Lernvideo zum Periodensystem der Elemente:
In diesem interaktiven Periodensystem kannst du dir die Elemente der acht Hauptgruppen genauer anschauen:
Übung: Baue mit dieser Lern-App die Atome nach, aus denen das Methylmethacrylat-Molekül besteht! Mache Bildschirmfotos und gib die Bilder in Deinem Lernmanagementsystem in der Lernlandkarte ab.
Edelgaskonfiguration
Alle Atome sind nach dem beschriebenen System neutral geladen. Sie haben also gleich viele Elektronen und Protonen. Der ideale Zustand eines Atoms ist aber die Anzahl von acht Elektronen auf der äußeren Schale. Dazu fehlen z.B. den Atomen in der ersten Hauptgruppe sieben oder sie haben ein Elektron zu viel.
Alle Atome wollen unbedingt acht Elektronen auf der äußersten Schale haben. Ausgenommen davon sind die Elemente in der achten Hauptgruppe. Auf ihrer äußeren Schale sind schon acht Elektronen. Man nennt das Edelgaskonfiguration. Sie heißen auch Edelgase (Helium, Neon, Argon, Krypton, Xenon und Radon mit Namen) und verbinden sich mit keinen anderen Atomen. Die Ausnahme von dieser 8er-Regel ist Helium. Es hat ja nur zwei Elektronen auf der äußeren Schale. Da dies die erste Schale ist, passen auch nur zwei Elektronen auf diese Schale. Helium hat daher mit diesen zwei Elektronen schon Edelgaskonfiguration.
Alle anderen Elemente müssen entweder zusätzliche Elektronen aufnehmen um die äußere Schale auf acht Elektronen aufzufüllen. Oder aber sie müssen die Elektronen auf der äußersten Schale abzugeben. Dann wird die volle Schale darunter zur äußeren Schale.
Um diesen idealen Zustand zu erreichen, verbinden sich Atome miteinander.
Bindungsarten
1. Verbindungsmöglichkeit: Elektronenabgabe bzw. -aufnahme. Am Beispiel des Kochsalzes ist das ganz einfach erklärt. Es besteht aus Natrium und Chlor. Natrium steht in der ersten Hauptgruppe. Es hat also ein Elektron auf der äußersten (dritten) Schale. Chlor steht in der siebten Hauptgruppe. Es hat sieben Außenelektronen. Gibt Natrium ein Elektron an Chlor ab, ist seine äußere Schale leer. Dadurch wird seine zweite Schale zur äußersten. Sie ist mit acht Elektronen voll besetzt. Chlor nimmt dieses Elektron auf. Es füllt damit seine äußerste Schale auf acht Elektronen auf.
Als Folge dieses "Elektronenaustauschs" stimmt aber die Anzahl der Elektronen und Protonen in den beiden Atomen nicht mehr. Natrium hat ein Elektron zu wenig. Es ist jetzt positiv geladen. Chlor hat ein Elektron zu viel hat und ist damit negativ geladen. Solche geladenen Atome nennt man Ionen. Ionen sind also positiv oder negativ geladene Atome. Ungleiche Ladungen ziehen sich an. Das kennst Du hoffentlich von einem Magneten. Also ziehen sich diese beiden unterschiedlich geladenen Ionen an. Sie bilden ein Kochsalz-Molekül.
Diese Bindungsart nennt man als Ionenbindung. Sie funktioniert nur zwischen Elementen mit jeweils wenig und vielen Außenelektronen, das bedeutet zwischen Metallen und Nichtmetallen. Metalle stehen links im Periodensystem. Nichtmetalle stehen rechts im Periodensystem.
2. Verbindungsmöglichkeit: Gemeinsame Nutzung von Elektronen.
Die Frage zu Beginn des Textes war: Wie schaffen es die Kohlenstoff-Atome des MMA sich zu verbinden?
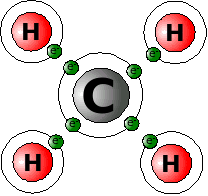
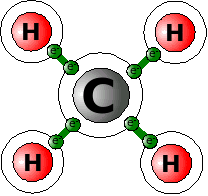
Als Beispiel dient das Molekül CH4 (Methan).
C (Kohlenstoff) hat vier Außenelektronen. Wasserstoff hat je ein Außenelektron. Kohlenstoff fehlen also vier Elektronen zur Edelgaskonfiguration. Jedem Wasserstoff fehlt dazu ein Elektron. Wasserstoff hat ja nur eine Schale. Diese ist mit zwei Elektronen voll gefüllt. Fünf Atome nutzen dazu jetzt ihre Elektronen gemeinsam. Das eine Kohlenstoffatom benutzt jedes Elektron der vier Wasserstoffatome mit. Damit stehen ihm jetzt acht Elektronen zur Verfügung. Es hat damit die Edelgaskonfiguration erreicht! Jedes Wasserstoffatom nutzt ein Elektron der vier äußeren Kohlenstoffelektronen mit. Jedes Wasserstoffatom hat also jetzt zwei Elektronen zur Verfügung. Es erreicht damit Edelgaskonfiguration!
Jetzt haben alle beteiligten Atome eine volle äußere Schale. Sie sind aber über die gemeinsame Elektronennutzung aneinander gebunden. Diese Art der Bindung nennt man Kovalente Bindung, Atom-Bindung oder Elektronenpaarbindung. Der letzte Name zeigt, dass man sich jeweils zwei gegenseitig zur Verfügung gestellte Elektronen als Elektronenpaar vorstellen kann.
3. Verbindungsmöglichkeit: Die Metallbindung. Sie ist hier nicht von Bedeutung. Du lernst sie im 3. Ausbildungsjahr kennen.
Überprüfe Dein neues Wissen mit dieser interaktive Übung zu den chemischen Grundlagen der Polymerisation in der Lernlandkarte. Als Schülerin oder Schüler des ADBK Düsseldorf bearbeitest du diese Übung bitte unbedingt in deinem Klassen-Moodle-Kurs!
Die Polymerisation
Die Kohlenwasserstoffe
Es gibt viele verschiedene Möglichkeiten, Kohlenstoff und Wasserstoffatome miteinander zu koppeln. Dabei kommt die Anzahl der zur Verfügung stehenden Außenelektronen zum Austausch nicht immer gut aus.
Prima funktioniert das bei den gesättigten Kohlenwasserstoffen (sogennante Alkane):
CH4 Methan
C2H6 Ethan
C3H8 Propan
C4H10 Butan
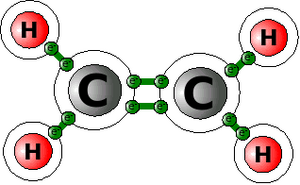
Weniger gut passt es bei ungesättigten Kohlenwasserstoffen (z.B. die Alkene):
C2H4 Ethen
C3H6 Propen
C4H8 Buten
Die ungesättigten Kohlenwasserstoffe benutzen einen Trick, da sie nicht genug Wasserstoffatome zur gemeinsamen Nutzung von Elektronen zur Verfügung haben. Es verwenden einfach die Kohlenstoffatome untereinander ihre Elektronen gemeinsam. Beim Ethen zum Beispiel ist das wie rechts abgebildet gelöst.
Skizziere die Strukturformel von Propen (du musst bestimmt ein wenig tüfteln ;-)).
Lernvideo zu den Kohlenwasserstoffen:
Diese sogenannte Doppelbindung macht diese Moleküle allerdings ein wenig instabil (ungesättigt eben). Sie würden gern ihre Doppelbindung in eine einfache umwandeln. Damit sind wir am Ausgangspunkt unserer Überlegungen angekommen:
Wie schaffen es die einzelnen Moleküle aber nun, so lange flüssig zu bleiben, bis wir sie verarbeiten wollen und wie schaffen sie es, ausgerechnet dann fest zu werden?
Die Doppelbindung hilft dabei!
Unser MMA-Molekül können wir dazu bringen, seine Doppelbindung zu öffnen, man sagt das Molekül wird radikal!
Ein solches radikales Molekül animiert ein anderes MMA-Molekül ebenfalls dazu radikal zu werden usw. Jetzt hängt aber rechts und links am Molekül ein offenes Elektron. Da jedes radikale Molekül aber jetzt zwei solche einsamen Elektronen hat, können diese sich zur gemeinsamen Nutzung zusammentun. Damit ist eine Kettenbildung ausgelöst.
Kettenbildung und Gesundheitsgefahren
Diese Kettenbildung, die Reaktion von ungesättigten Verbindungen zu Makromolekülen, nennt man Polymerisation.
Die Polymerisation soll natürlich nicht automatisch zu irgendeinem Zeitpunkt ablaufen sondern erst dann, wenn wir den Individuellen Abformlöffel soweit fertig haben, dass er hart werden soll.
Deshalb sind dem Monomer Moleküle zugemischt, die radikale Moleküle einfangen und sie blockieren. Gäbe es sie nicht, würde die Monomerflüssigkeit im Laufe der Zeit von selbst hart werden und wäre nicht lagerfähig. Solche Stoffe nennt man Inhibitoren (lat. inhibere = verhindern).
Gleichzeitig sind dem Monomer Moleküle beigemischt, die die Kettenbildung (Polymerisation) gezielt auslösen. Das sind Moleküle, die "auf Befehl" radikal werden und so den Beginn einer Kette darstellen, die dann rasant schnell von allein immer länger wird. Diese Moleküle heißen Initiatoren (sie initiieren sozusagen die Kettenbildung). Initiatoren reagieren entweder auf UV-Licht (Lichthärtender Kunststoff) oder auf ein Partnermolekül im Pulver, mit dem das Monomer vermischt wird (Autopolymerisat). Initiatoren haben als erstes Molekül in der Kette nur ein freies Elektron!
Übrigens, das Pulver ist nichts anderes als schon fertig polymerisiertes Monomer, dass in ganz kleinen Kügelchen vorliegt.
Eine Polymerisation läuft daher in drei Phasen ab.
- Kettenstart (Startreaktion): Ein Initiator wird durch UV-Licht oder ein Partnermolekül aus dem Pulver radikalisiert und bildet das Startmolekül einer Molekülkette. Die weiteren Moleküle radikalisieren sich gegenseitig.
- Kettenwachstum (Wachstumsreaktion): Die weitere gegenseitige Radikalisierung hält das Wachstum der Kette in Gang. Läßt man diese Reaktion ungestört (Achtung Herstellerangaben zur Polymeristaionszeit unbedingt einhalten) ablaufen, bilden sich lange vernetzte Ketten und es bleibt wenig Restmonomer (nicht in Ketten eingebaute Monomer-Moleküle) übrig.
- Kettenabbruch (Abbruchreaktion): Es gibt mehrere Möglichkeiten die Reaktion zu beenden:
- Fast alle Monomermoleküle sind verbraucht, die Polymerisation ist fertig. Es bleiben allerdings immer ein paar restliche Monomermoleküle übrig, die noch kein Kettenende gefunden haben. Ist dieser Restmonomergehalt zu hoch, kann auch der fertige Kunststoff ähnlich schädlich wie das Monomer sein.
- Ein radikaler Initiator mit nur einem freien Elektron gelangt an das Ende einer Kette. Da das zweite Elektron fehlt, geht's an dieser Stelle nicht weiter, für diese Kette ist das Wachstum beendet.
- Ein Inhibitor setzt sich an ein Kettenende und blockiert das weitere Wachstum. Dummerweise funktioniert Sauerstoff (der in der Luft ja auch vorhanden ist) als Inhibitor für die Initiatoren des UV-Lichthärtenden-Kunststoffs. Somit wird die Kettenbildung an der Oberfläche der Kunststoffplatten durch Sauerstoff blockiert, eine nicht polymerisierte Schicht aus Monomer-Polymer-Gemisch bleibt zurück. Sie wird Inhibitionsschicht genannt.
Nun weißt du, wie Kunststoff hart wird. Er polymerisiert in langen Molekülketten. Die Gesamtheit aller Atombindungen, die im Polymer vorkommen, nennt man Primaärbindungen. Da sich die Ketten der vielen einzelnen Polymerisationsreaktionen auch physikalisch miteinander verknoten, spricht man hierbei von der Sekundärbindung.
Gesundheitlich problematisch ist dieser polymerisierte Kunststoff nur, wenn man ihn bearbeitet und dabei kleine Späne entstehen. Man kann über diese Späne in Kontakt mit Restmonomer kommen. Umso gefährlicher ist das noch nicht polymerisierte Monomer-Molekül. Den Kontakt mit diesen Molekülen (auch über die Atemluft, du kannst Monomer riechen) musst du unbedingt vermeiden. Hautausschläge, Allergien, Übelkeit und viele weitreichende Gesundheitsschädigungen können die Folge des Kontaktes sein. Deshalb gibt es eine verpflichtende Betriebsanweisung der Berufsgenossenschaft zum Umgang mit Methylmethacrylat im Labor, die dich vor diesem Zeug schützen soll!
Folgende Gefahrenkennzeichnungen gelten für Methacrylsäuremethylester (H- und P-Sätze):
- H: 225‐315‐317‐335
- P: 210‐233‐280‐302+352‐304+340‐403+235
Mehr darüber erfährst du im weiteren Verlauf des Unterrichts im Artikel Arbeits-_und_Gesundheitsschutz.
Lernvideo zur radikalischen Polymerisation:
Überprüfe dein neues Wissen mit dieser interaktive Übung zur radikalischen Polymerisation. Als Lernende des ADBK Düsseldorf bearbeitest du diese Übung bitte unbedingt in deinem Klassen-Moodle-Kurs!